Una reacción química es un proceso mediante el cual una, dos
o más sustancias (reactivos) se combinan químicamente mediante la participación
de la energía para formar una o más sustancias nuevas (productos).
Básicamente existen cuatro tipos de reacciones químicas:
- Síntesis
- Análisis
- Sustitución
- Doble sustitución
Si representáramos las sustancias químicas por literales
estaríamos en posibilidad de elaborar modelos matemáticos sencillos de estas
ecuaciones.
Balanceo de Ecuaciones Químicas
Ecuación química
- Los compuestos que se encuentran del lado izquierdo de la flecha se llaman reactivos.
- La flecha significa “produce”.
- Los compuestos que se encuentran a la derecha de la flecha se llaman productos.
- El coeficiente es el número que se escribe a la izquierda de la fórmula, representa el número de moléculas que hay de la sustancia. Los coeficientes 1 no se escriben.
El
subíndice es el número que se escribe a la derecha y debajo de los elementos
químicos, representa el número de átomos que hay en una molécula. Los
subíndices 1 no se escriben.
Balancear
Consiste
en hacer que una ecuación cumpla con la ley de la conservación de la materia de
Antoine Lavoisier: “La materia no se crea ni se destruye solamente se
trasforma”. Para balancear una ecuación química se emplean solamente
coeficientes.
Ley de la Conservación de la Materia
Aplicada
a una ecuación química podría interpretarse como “la cantidad de átomos que
entran en un proceso químico tendrá que ser la misma que lo termine”.
Métodos de balanceo de ecuaciones químicas
Las
ecuaciones químicas se pueden balancear por el método de Tanteo o por el método
de Redox.
Método de tanteo
Método de tanteo paso a paso
Se cuenta la cantidad de elementos del lado de los reactivos
y se contrasta con el mismo elemento que se encuentra del lado de los
productos.
Paso 1.
- 1 átomo de plata (Ag) en los reactivos y 2 átomos de plata en los productos, la plata está desbalanceada.
- 1 átomo de nitrógeno (N) en los reactivos y 1 átomo de nitrógeno en los productos, el nitrógeno está balanceado.
- 3 átomos de oxígeno (O) en los reactivos y 3 átomos de nitrógeno en los productos, el oxígeno está balanceado.
- 2 átomos de hidrógeno (H) en los reactivos y 1 átomo de hidrógeno en los productos, el hidrógeno está desbalanceado.
- 1 átomo de azufre (S) en los reactivos y 1 átomo de azufre en los productos, el azufre está balanceado.
Paso 2. La plata (Ag) y el hidrógeno (H) están desbalanceados, para balancearlos se utilizan los coeficientes.
Paso 3. 2 átomos de plata en los productos y 1 átomo de plata en los reactivos, para balancear la ecuación:
Paso 4.
• Se coloca un coeficiente 2 en la molécula
de nitrato de plata (AgNO3).
• El coeficiente 2 balancea la plata y afecta a toda la molécula.
• Ahora hay 2 platas, 2 nitrógenos y 6 oxígenos.
Paso 5. Para compensar el balance se coloca un coeficiente 2 en la molécula de ácido nítrico (HNO3).
Paso 6. Se procede a contar nuevamente.
• 2 átomos de plata (Ag) en los reactivos y 2 átomos de plata en los productos, la plata está balanceada.
• 2 átomos de nitrógeno (N) en los reactivos y 2 átomos de nitrógeno en los productos, el nitrógeno está balanceado.
• 6 átomos de oxígeno (O) en los reactivos y 6 átomos de oxígeno en los productos, el oxígeno está balanceado.
• 2 átomos de hidrógeno (H) en los reactivos y 2 átomos de hidrógeno en los productos, el hidrógeno está balanceado.
• 1 átomo de azufre (S) en los reactivos y 1 átomo de azufre en los productos, el azufre está balanceado.
Al quedar todos
los elementos balanceados, la ecuación cumple con la ley de la conservación de
la materia de Lavoisier.
Método de redox
Las ecuaciones químicas se pueden balancear por el método de
Tanteo o por el método de Redox.
METODO DE REDOX. - es la unión de las palabras reducción y oxidación.
REACCIONES REDOX. - Hay un intercambio de electrones: mientras
una sustancia gana electrones otra los pierde.
REDUCCION. - Un elemento se reduce cuando gana electrones.
OXIDACION. - Un elemento se oxida cuando pierde electrones.
BALANCEO DE REDOX. - Para balancear por el método de redox
es necesario calcular el número de oxidación de cada uno de los elementos que
participan en una formula química.
NUMERO DE OXIDACION. - Es la carga positiva (+) o negativa (-)
que tiene un átomo. También es el número de electrones que un átomo ha ganado o
perdido en una reacción química.
Método de redox paso a paso
Se calculan los números de oxidación de cada uno de los
elementos que intervienen en la ecuación.
Paso 1. Se calculan los números de oxidación de cada uno
de los elementos que intervienen en la ecuación.
Paso 2. Consulta la tabla periódica de los elementos
para calcular el número de valencias oxidadas o reducidas. La valencia
se define como la capacidad de combinación de un átomo.
------> Oxidación -6 -5 -4 -3 -2 -1 0 1 2 3 4 5 6
Reducción <--------
Paso 3.
• El hierro Fe pasó de 0 a +3 se Redujo en 3 valencias
• El oxígeno pasó de 0 a -2 se oxido en 2 valencia
• Los coeficientes encontrados se escriben debajo de los elementos encontrados.
• Cruzándolas se anotan como coeficientes.
Paso 4. Una vez calculados los coeficientes se termina
balanceando la ecuación por el método de Tanteo.
• Entra 2 átomos de Hierro (Fe) salen 2 átomos de (Fe) Hierro Balanceado
• Entran 6 átomos de oxigeno (O) y Salen 6 átomos de (O) oxígeno Balanceado
• La ecuación balanceada queda como se observa.
Balanceo de la ecuación por redox
Paso 1. Balancear la ecuación por redox.
Paso 2. Se calculan los números de oxidación de cada uno
de los elementos que se encuentran presentes en la ecuación.
Paso 3. Se buscan los elementos en los cuales su número de oxidación cambió.
 Paso 4. Se consulta la tabla para calcular el número de
valencias oxidadas o reducidas.
Paso 4. Se consulta la tabla para calcular el número de
valencias oxidadas o reducidas.
Paso 5. El
nitrógeno se redujo en 3 valencias.
Paso 6. El estaño se oxidó en 2 valencias.
Paso 7. Los números encontrados se anotan debajo de sus
fórmulas correspondientes.
Paso 8. Cruzándolos se anotan como coeficientes,
quedando como se muestra.
Paso 9. Se termina de balancear la ecuación por el
método de tanteo.
Paso 10. Comprobación.
Cuando cada uno de los elementos que participan en la
ecuación química cumple con la ley de la conservación de la materia se puede
decir que la ecuación está correctamente balanceada.














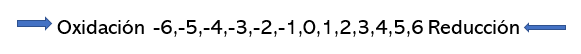








No hay comentarios.:
Publicar un comentario