|
Sabías que … A través de la respiración, los animales, incluidos el ser humano, producen dióxido de carbono. |
En este tema vamos a comprender y analizar cuáles son los tipos de reacciones químicas que intervienen en la formación de gases de efecto invernadero (GEI) se debe recordar que una reacción química es aquellas donde una o más sustancias (reactivos) se transforman, produciendo sustancias nuevas (productos). Lo que sucede en una reacción es un rearreglo de átomos.

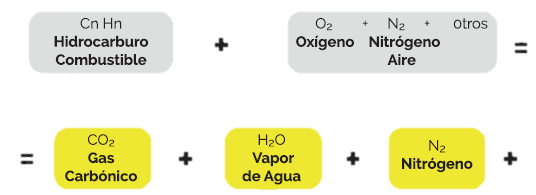
La combustión es una reacción de la que se libera una gran cantidad de energía, por eso se le llama exotérmica, en este tipo de reacciones es necesario un combustible, elemento que arde, entre los que están del carbón vegetal, la madera, el gas natural, el propano, la gasolina o el petróleo; y un comburente, aquel que produce la combustión, generalmente es el oxígeno en forma de gas.
La reacción del combustible con el oxígeno origina sustancias gaseosas, entre las cuales las más comunes son dióxido de carbono (CO2) y el vapor de agua (H2O). Un ejemplo de reacción es la combustión del metano:
Donde los reactivos son metano y oxígeno y los productos son dióxido de carbono y agua.
En ocasiones al color de la flama o llama es azul o amarilla, el motivo es por el tipo de combustión que sucede: combustión completa y combustión incompleta.
En la combustión completa el oxígeno es suficiente, el humo generado es blanco, no se crean residuos, la llama es azul y se produce dióxido de carbono (CO2) y agua (H2O). Mientras que en la combustión incompleta hay poco oxígeno, la llama es amarilla y seis generar carbono (C), monóxido de carbono (CO), dióxido de carbono (CO2) y agua (H2O).
Producto de combustión completa
Se tiene suficiente oxígeno, el humo generado es blanco, no se generan residuos, la llama es azul y se produce dióxido de carbono (CO2) y agua (H2O).
Productos de combustión incompleta.
Se tiene poco oxígeno, se produce un humo negro, deja residuo negro (hollín), la llama es amarilla y se producen carbono (C), monóxido de carbono (CO), dióxido de carbono (CO2) y agua (H2O).
Los productos que se obtengan en la combustión dependerán del tipo de combustión.
El óxido nitroso (N2O) también se produce por la combustión de combustibles fósiles (para generar energía o de automóviles) o en la pirotecnia. Este se produce generalmente a partir de una reacción termina del nitrato de amonio (NH4NO3), descomponiéndose en vapor de agua y óxido nitroso (N2O).
|
La descomposición de la materia orgánica, presentes en los desechos de comida o la hojarasca, mediante la biodegradación, también produce dióxido de carbono, agua y metano. |
Otro tipo de reacciones por las que también se forman algunos gases de invernadero son las bioquímicas. Estas ocurren en los organismos vivos, ya sea para la síntesis o degradación de compuestos (reacciones metabólicas).
La reacción de degradación de bacterias desnitrificantes (reacción metabólica) que utilizan el nitrógeno (N) de los nitratos (NO3) también participa en la formación de óxido nitroso. Este proceso se presenta debido al uso excesivo de fertilizantes nitrogenados y a la falta de oxígeno en el suelo, provocando que el nitrógeno de los nitratos regrese a la atmósfera como óxido nitroso (N2O).
Otras reacciones bioquímicas son la respiración aerobia (en presencia de oxígeno u la anaerobia (en ausencia de oxígeno), las cuales forman gases de efecto invernadero.
En la respiración aerobia, la reacción se da a partir de la glucosa (hidratos de carbono) y oxígeno, produciendo dióxido de carbono, agua y energía en forma de adenosín trifosfato (ATP).
Respiración aerobia.
En la respiración anaerobia se produce metano (CH4) por fermentación anaeróbica de los carbohidratos (celulosa, almidón, sacarosa). Las heces excretadas por los animales domésticos también provocan metano.
Ilustración 1 Metano de origen entérico. Se produce en el rumen (panza) de rumiantes como las vacas, cabras, ovinos y venados.
Un ejemplo de reacción es la que ocurre en la regulación de la concentración de dióxido de carbono y que además produce oxígeno, dando origen a la fotosíntesis, realizada por plantas y algunos tipos de algas. En este proceso se emplea al dióxido de carbono como materia prima, además de agua y luz (reactivos) para la formación de glucosa y oxígeno. Es importante contemplar que es un proceso complejo.
Ilustración 2 Productos y reactivos presentes en la reacción de fotosíntesis.
¿Recuerdas la lluvia acida? En la siguiente imagen se muestra la reacción química que acontece en la atmósfera mediante la cual se forma. Notaras que con este fenómeno el agua se contamina.
Ilustración 3 Formación de la lluvia acida mediante la reacción química del dióxido de azufre (SO2) y/o dióxido nitroso (NO2)
Te darás cuenta de que la naturaleza cambiante de los compuestos y los elementos en el planeta, así como de su capacidad para unirse o separarse, participan en la formación de nuevos productos.
El ser humano se ha aprovechado de la capacidad de la reacción entre sí de los compuestos y elementos para producir energía, permitiendo el desarrollo tecnológico y económico.
Una parte importante de la generación de energía, de la cual el hombre descubrió, es que la cantidad que se obtiene de la combustión dependerá, no solo el tipo de reactivo, sino también de la cantidad de este en la reacción. Por ello, es importante saber que la rama de la química encargada de estos cálculos es la estequiometria.
























 Paso 4.
Paso 4.