Funciones.
- Moléculas formadoras de las proteínas,
- Precursores de vitaminas (β-alanina).
- Intermediarios en la síntesis de otros aminoácidos.
- Presentes en las paredes celulares de bacterias.
- Como neurotransmisores.
- Hay varios que en plantas tienen funciones desconocidas.
 Aminoácidos esenciales y no esenciales.
Aminoácidos esenciales y no esenciales.
Todos son indispensables, pero los esenciales no son sintetizados por el metabolismo humano, por lo que necesitan ser ingeridos en productos que si los contienen y en los que son sintetizados por otros organismos.
Niveles de estructuración de las proteínas.
Primario
Se refiere a la secuencia de aminoácidos de una proteína. Describe los enlaces covalentes (enlace peptídico y puentes de disulfuro) que unen los residuos aminoácidos de una cadena polipeptídica. Una de las características del enlace peptídico es que es planar, el cual es determinado por la estructura resonantes del mismo enlace. Teniendo una incapacidad de rotación, también conocida como conformación restringida.

- Ordenamiento lineal de aminoácidos, en cadenas no ramificadas.
- Posición específica de cada aminoácido en la cadena secuencia específico.
- Unión covalente aminoácido-aminoácido (enlace peptídico)
- La cadena de de aminoácidos tiene dos extremos: uno amino, otro carboxilo.
secundaria.

Se refiere a la disposición estable de los aminoácidos en una región local del péptido lo cual da lugar a patrones estructurales repetidos.
- 1. Tiene un arreglo periódico.
3. Promovida estabilizada por puentes de hidrógeno.
Existen tres tipos de estructura secundaria: hélice (α), plegada (β) y de giros o asas.
El tipo de hélice (α) tiene las siguientes características:
- Tiene cadena helicoidal.
- 3.6 aminoácidos por vuelta (5.4A)
- Los grupos R se encuentran hacia afuera de la hélice.
- Formación de puentes de hidrógeno con periodicidad regular intervienen el Hidrógeno(H) del:
- Enrolladas a hacia la derecha.
- Es una forma de estructura secundaria.
- Tiene una disposición planar en el espacio.
- Esta estabilizada por puentes de hidrógeno.
- Carbonilo e imino de la cadena polipeptídica.
- Las cadenas pueden correr en forma paralela o antiparalela.
- Los grupos R se encuentran hacia arriba y hacia abajo del plano.
Las β-plegadas se pueden generar por varias cadenas polipeptídicas o por secciones diferentes de la misma cadena polipeptídica.
Estructura terciaria.
Se le conoce también como vueltas o giros y asas.
- * Estructuras secundarias en forma de U.
- * Estabilizadas por puentes de H en sus extremos.
- * Formadas por tres o cuatro residuos.
- * Se localizan en la superficie de las proteínas generalmente.
- * Forman un doblamiento acentuado de la cadena polipeptídica que la reorienta hacia el interior.
- * Prolina favorece las vueltas o giros así como glicina, por tener un pequeño R.
- * Sin estas vueltas, las proteínas serian largas cadenas de aminoácidos extendidas (aunque con α-hélices o β-plegadas), y no serian estructuras compactas.
- * Las ASAS (loops) son mas extensas y tienen diferentes formas.
Las proteínas membranales tienen regiones hidrofóbicas ( en la parte apolar de la membrana) y regiones hidrofílicas (en la región citosólica o extracelular si se trata de una membrana plasmática).
 Las proteínas membranales tienen también una estructura primaria, secundaria, terciaria y cuaternaria.
Las proteínas membranales tienen también una estructura primaria, secundaria, terciaria y cuaternaria.motivos, estructuras supersecundarias y dominios.
Un motivo será una estructura secundaria:
Una estructura supersecundaria será un agregado de por los menos dos motivos y pueden 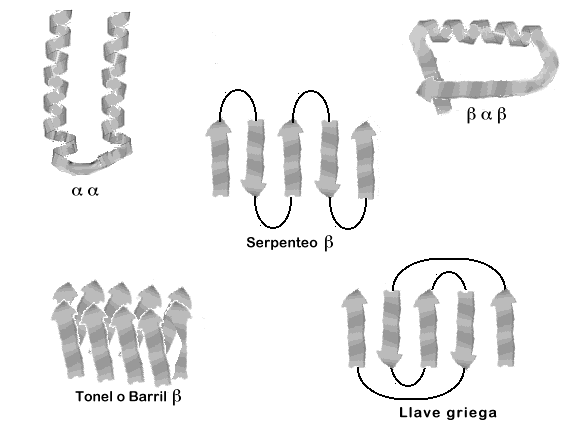 tener combinaciones de α-hélices, β-plegadas y giros. Por ejemplo:
tener combinaciones de α-hélices, β-plegadas y giros. Por ejemplo:
 tener combinaciones de α-hélices, β-plegadas y giros. Por ejemplo:
tener combinaciones de α-hélices, β-plegadas y giros. Por ejemplo:- α-hélices, giro, α-hélices
- β-plegadas, giro, α-hélices, etc.
Un dominio será un agregado compacto de varias superestructuras unidas a otro por un segmento flexible.