Los enlaces que mantienen a los átomos juntos en compuestos
se denominan fuerzas intramoleculares
los tres principales tipos son:
·
Los enlaces iónicos.
·
Los enlaces covalentes.
·
Los enlaces metálicos.
Enlaces covalentes
Los enlaces covalentes son estables debido a que los átomos
enlazados alcanzan una configuración de gas noble al compartir electrones.
El nombre covalente sugiere que los átomos comparten
electrones de valencia, podemos demostrarlo mediante un diagrama de puntos de
Lewis.
El fluoruro de hidrógeno es una molécula con un enlace
covalente simple formado entre dos átomos, el flúor posee siete electrones de
valencia y el hidrógeno uno.
Al compartir dos electrones en un enlace ahora el Hidrógeno(H) posee dos electrones de valencia y tiene
la misma configuración que el gas noble Helio (He)
El flúor tiene ahora ocho electrones y posee la misma
configuración que el gas noble Neón (Ne).
En el diagrama de Lewis podemos reemplazar los dos
electrones compartidos por una línea recta simple que representa el enlace
covalente simple.
En ocasiones dos átomos comparten más de dos electrones. En
el caso de un enlace covalente doble o triple tenemos un ejemplo de ello en el Dióxido
de Carbono CO2.
La estructura de Lewis se ve así:
El Carbono (C) tiene cuatro electrones de valencia y el
Oxigeno (O) tiene seis.
El carbono requiere cuatro electrones más para ganar la
configuración de un gas noble, el oxígeno necesita dos para lograrlo, esto se
puede conseguir si el átomo de carbono forma dos enlaces dobles con cada átomo
de oxígeno.
Podemos reemplazar los dos pares de electrones compartidos
en el diagrama con dos líneas dobles que representen el doble enlace.
Enlaces covalente no polares
Si son idénticos los dos átomos en un enlace covalente poseen
exactamente la misma electronegatividad el uno con el otro. El enlace entre
estos átomos idénticos se denomina enlace
covalente no polar.
Por ejemplo, el Hidrógeno existen en la naturaleza como una molécula
diatómicas, el H2, los dos átomos de hidrógeno tiran de igual manera
en el par de electrones compartidos en el enlace con lo cual no hay direccionalidad
o polaridad en el enlace.
Comparando esta
situación con los enlaces de una molécula polar como la del agua (H2O) el oxígeno es mucho más
electronegativo que el hidrógeno por lo cual los electrones en los enlaces
pasan mayor cantidad de tiempo alrededor del oxígeno que del hidrógeno.
A esta forma dispareja de compartir electrones la
denominamos enlace covalente polar.
Esto deriva a que la molécula del agua sea derivada en su
conjunto un lado de la molécula es más negativo que el otro lado, se utiliza
una letra delta minúscula (d)
para mostrar la carga parcial negativa en el átomo de oxígeno y la carga
parcial positiva en los átomos de hidrógeno.
Se utiliza esta
notación con la delta para distinguir estas cargas parciales de las cargas
totales que tienen los iones. Es posible confundirse entre las moléculas que
contienen enlaces covalentes polares y las que son polares en su conjunto. El
agua es ambas cosas, poseen expolares y es una molécula polar en su conjunto,
debido a que es un extremo de su molécula es levemente positivo y el otro
extremo es levemente negativo, es como resultado de los enlaces covalentes que
mantienen junta a la molécula de agua.
La molécula de
Tetracloruro de Carbono (CCl4)
el cloro es más electronegativo que el carbono por lo cual esta molécula tiene
cuatro enlaces de covalente polares, se podría pensar que añadiendo cuatro
enlaces covalentes juntos esta molécula se volvería muy polar, pero en la
realidad cuando se ve la estructura tridimensional podemos notar que los
enlaces apuntan en cuatro direcciones opuestas

Con lo cual se cancelan entre ellas, no encontramos un lado
del tetracloruro de carbono que sea más negativo o positivo que el otro, con lo
cual el tetracloruro de carbono en su conjunto es una molécula no polar.
Por lo general lo químicos miden la polaridad de un enlace
utilizando la escala establecida por Linus Pauling.
Si las electronegatividades relativas de los dos átomos
enlazados difieren en menos de 0.4 en la escala de Pauling es considerado como covalente no polar.
Si las diferencias entre las electronegatividades relativas
está entre 0.4 y 1.7 se le denomina enlace
covalente polar y si
las electronegatividades difieren en más de 1.7 se trata de un enlace iónico.
Tal como sucede con la mayoría de los enlaces iónicos los
enlaces covalentes son separados por el agua, algunos si y otros nos, por ejemplo,
la sacarosa (C12H22O11)
que es la azúcar de mesa, es una molécula con átomos que se mantienen juntos
mediante enlaces covalentes.
Si pones la sacarosa u otro azúcar en agua los enlaces
covalentes permanecen intactos, la solución
de agua y azúcar no conduce electricidad, como si lo hace la solución de agua y
sal, en contrapartida los ácidos como el ácido hidroclórico (HCl) son compuestos covalentes que rápidamente
se separan en iones en H+ y Cl-, por lo cual si conducen electricidad a estas
sustancias se les llama electrolitos,
actúan de esta manera, la mayoría de las sales , ácidos y bases solubles, pese
a que algunos enlaces covalentes pueden separarse en el agua son considerados
enlaces fuertes, los enlaces iónicos son enlaces fuertes también.
Enlaces iónicos
Un enlace iónico está formado por la atracción electrostática
entre dos iones con cargas opuestas, uno positivo (el catión) y uno negativo
(el anión).
Por lo general, el catión es un metal y el anión es un no
metal. Un ejemplo cotidiano es el del enlace que forma la sal de mesa (NaCl). Los
iones de Sodio (Na+) son fuertemente atraídos por los iones de Cloro (Cl-),
cuando se juntan en un enlace iónico, sus cargas opuestas se cancelan y forman
un compuesto eléctricamente neutral.
Debemos recordar al escribir la fórmula de un compuesto iónico:
las cargas totales positivas de los cationes tienen que ser iguales a las
cargas totales negativas de los aniones, para así formar un compuesto iónico
neutral.
Se puede escribir la formación del enlace iónico en la NaCl
utilizando estructuras de puntos de Lewis.
En la reacción:
2Na(s)+Cl2(g) ® 2NaCl(s)
Por cada unidad de la formula NaCl, un átomo de sodio pierde
un electrón y un átomo de cloro gana un electrón.
Podemos escribir esa
reacción de esta manera: un átomo de Sodio que tiene un electrón de valencia le
entrega ese electrón a un átomo de Cloro, el cual tiene 7 electrones de
valencia. Ahora el ion de Sodio posee la misma configuración de electrones que
la del gas noble Neón. Al perder ese electrón extra, tiene un octeto completo
de electrones de valencia.
Al ganar un electrón, el ion de Cloro tiene ahora la misma configuración
de electrones que la del gas noble Argón. Los iones con cargas opuestas que se
atraen fuertemente entre ellos se ordenan hasta formar una red de tres
dimensiones, en la cual cada ion de Sodio está rodeado por seis iones de Cloro,
y cada ion de Cloro está rodeado por seis iones de Sodio.
Usando la estructura
de puntos de electrones para determinar la fórmula química de un compuesto iónico
formado cuando reaccionan el Potasio (K) con el Oxígeno (O).
El Potasio (K) es un
metal que tiene un electrón de valencia, el Oxígeno (O) es un no metal que
tienen seis electrones de valencia. Un átomo de Potasio (K) perderá un electrón
y se convertirá en un catión con una carga de +1, y entonces tendrá una capa
de valencia completa. Para que el Oxígeno (O) pueda tener una capa de valencia
completa, tendrá que tomar dos electrones. El anión de Oxígeno (O) tiene una
capa de valencia de -2. Para enlazar esa carga negativa de dos tendrá que
enlazar con dos cationes de Potasio (K), que cada uno tiene +1. Entonces la fórmula
del compuesto iónico es de K2O, Oxido de Potasio.
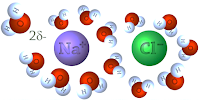
Los enlaces iónicos como
aquellos en NaCl son fácilmente desarmados en agua: los iones se separan y son
rodeados por moléculas de agua. A eso lo llamamos “capa de solvatación” o “capa
de hidratación”. Teniendo en cuenta que las
moléculas de agua se ordenan de tal manera que los oxígeno parcialmente
negativos en el agua se orientan hacia los iones positivos del Sodio, y que los
hidrógenos parcialmente positivos en el agua apuntan hacia los iones negativos
del cloro.
Debido a que los iones se
pueden mover libremente cuando están disueltos en agua, las soluciones acuosas
de compuestos iónicos pueden conducir electricidad. No todos los enlaces iónicos
son solubles al agua. Esto no es algo que se pueda resolver con solo observar
la tabla periódica: la solubilidad se determina por experimentación.
Es posible que se vea una
tabla de reglas se solubilidad, pero se trata de un sumario de resultados
experimentales. Los compuestos iónicos incluyen nitratos, por ejemplo, solubles
al agua. La mayoría de los cloruros (como el NaCl), son solubles al agua, pero con
algunas excepciones, entre los cuales están los compuestos cloruros que
incluyen plata, mercurio y plomo. Pese a que por lo general se separan en el
agua, los enlaces iónicos son considerados fuertes, los enlaces covalentes
también son fuertes.




















No hay comentarios.:
Publicar un comentario