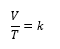Para cualquier gas la
relación entre la temperatura y el volumen es directamente proporcional.
Si todo lo demás se mantiene constante, a medida que suba la
temperatura, el volumen también aumenta. Y cuando baja la temperatura de un
gas, también lo hace el volumen.
Si calientas un gas, se expande las partículas y se mueve
más rápidamente y ocupa mayor espacio. imagínate un globo que se expande cuando
los particulares del gas chocan contra sus paredes (al expandirse, eso mantiene
en la presión constante). Cuanto más rápido se mueven las partículas, más
presionarán sobre las paredes del globo, expandiéndolo.
Por el contrario, si enfrías el gas – apoyas el globo sobre
hielo - eso aminora el movimiento de las partículas, y entonces el globo se
contrae.
Jacques Charles tiene la autoría sobre esta Ley de los Gases
que relaciona la temperatura y el volumen, pese a que no el público. Un colega
suyo, Joseph Louis Gay-Lussac, fue quien el público, pero honradamente le dio
autoría a Charles. La ley de Charles sostiene que, para una cantidad dada de gas
a una presión constante, la temperatura y el volumen son directamente
proporcionales.
Lo puedes escribir de modo matemático:
Donde V es igual a volumen, T es igual a temperatura en
grados kelvin, y K es una constante de proporcionalidad. Reacomodar la ecuación
para que se lea así:
O, dicho de otro modo, la proporción de volumen sobre la
temperatura es una constante K.
Con mucha frecuencia
la ley de charles es utilizada para comparar dos situaciones, un “antes” y un “después”.
En este caso podrás decir que V1 /T1 =k y V2 /T2
=k con lo cual podrás escribir la ley de Charles de esta manera:
Un globo aerostático posee un
volumen 2800 m³ a 99 °C ¿cuál será el volumen si el aire es enfriado a 80 °C?
Recuerda convertir la
temperatura a grados kelvin.
A 0 °C, un caos ocupa 22.4litros ¿a qué temperatura debería
estar en grados Celsius, para alcanzar un volumen de 25.0litros?
La ley de Charles vincula la temperatura y el volumen de un gas, pero existen otras leyes de los gases que relacionan otras variables asociadas a los gases.