Las primeras mediciones experimentales del comportamiento
térmico de los gases fueron realizadas por Robert Boyle (1627-1691). Él llevó a
cabo un estudio exhaustivo de los cambios en el volumen de los gases como
resultado de cambios en la presión. Las demás variables, como la masa y la
temperatura, se mantuvieron constantes.
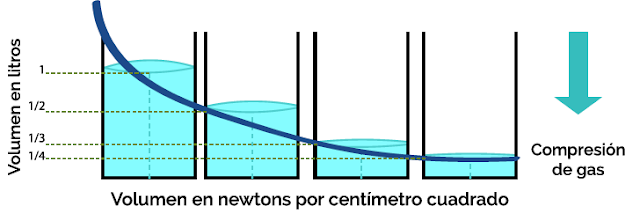
Boyle encontró que cuando la presión se disminuye a la
mitad, el volumen se duplica, es decir, que existe una variación proporcional
inversa entre las dos cantidades.
Sus resultados fueron llamados:
Ley de Boyle
“A temperatura constante, el volumen
de una masa gaseosa es inversamente proporcional a la presión que se aplica.”
Tenemos un volumen de gas V₁ que se
encuentra a una presión P₁. Si variamos el volumen de gas hasta V₂, entonces la
presión cambiará a P₂.
P₁ V₁ = P₂
V₂
Ejemplo
¿Qué volumen de gas hidrógeno a presión atmosférica se
requiere para llenar un tanque de 5000cm3 bajo una presión de 530 Pa ?
Primero identifiquemos las condiciones iniciales y las
condiciones finales. Las condiciones iniciales serán la presión atmosférica,
cuyo valor es 101325 Pa, y el volumen de gas hidrógeno que estamos buscando.
Las condiciones finales serán el volumen del tanque y la presión que este
posee.
|
|
Tomemos
la expresión de la ley de Boyle
|
|
|
Despejemos
el volumen inicial
|
|
|
Sustituyamos
valores
|
|
|
Multipliquemos
las cantidades del numerador
|
|
|
Dividamos
los valores
|
|
|
Simplifiquemos
unidades
|
|
|
Volumen
de hidrógeno buscado
|