Calor y temperatura.
 Seguramente habrás experimentado la sensación de calor
y frío al tocar un objeto.
Seguramente habrás experimentado la sensación de calor
y frío al tocar un objeto.
A pesar de que a través del tacto se pueden distinguir dos cuerpos, el caliente y el frío, siempre será una cualidad que se podrá cuantificar físicamente (que tan caliente o frío es algo) con respecto a un cuerpo determinado. A esa medida se le denomina temperatura y se mide con un instrumento llamado termómetro.
La temperatura y el calor no son lo mismo, pero están muy ligados. Para comprender la diferencia entre ellos se explicará los conceptos de la materia y sus propiedades.
Todo material se forma por átomos o moléculas que están en movimiento aleatorio, por lo tanto, tienen energía cinética, si se les agrega calor se mueven con mayor rapidez y con ello, aumenta la energía cinética.
Ilustración 1 A nivel de la organización.
Ilustración 2 Vista desglosada de la materia.
Una vez retomadas las propiedades de la materia se revisarán dos definiciones comunes:
a) Temperatura es una medida de la energía molecular media.
b) Calor es la energía total del movimiento molecular en una sustancia.

La temperatura es una magnitud física y las unidades que se utilizan para medir las son tres, llamadas grados: Centígrados o Celsius (ºC), Fahrenheit(ºF) y Kelvin(ºK). Cada una de ellas tiene una diferente escala termométrica, puesto que sus creadores tomado como referencia diferentes tipos de ebullición y de congelación del agua. Para poder utilizar indistintamente debe de hacer una relación de conversión.
En conclusión, el calor es una forma de energía, cuyo nombre es energía térmica o energía calorífica, por lo cual las unidades para medir el calor son las mismas del trabajo mecánico y de la energía. En el Sistema Internacional (SI) el calor se mide en Joules.
Cuando se transfiere el calor a un cuerpo un sustancial, éste se convierte en energía térmica, ya que ocurre una transformación de la energía cinética a energía térmica. Cuando dos cuerpos o sustancias encuentran en contacto térmico, “el calor fluye espontáneamente desde un objeto más caliente hacia uno más frío, pero no en sentido inverso”, como dice la Segunda Ley de la Termodinámica.
A continuación, se muestran algunos ejemplos:
|
La energía térmica fluye de la taza de café a la mano |
|
|
La energía térmica fluye de la mano de hielo |
Pero esta transferencia no necesariamente fluye de una sustancia con más energía térmica hacia otra con menor energía térmica. El calor nunca, por sí mismo, fluye de un cuerpo frío hacia uno caliente. Por eso hay más energía térmica en un tazón de agua caliente que en un clavo al rojo vivo. Si el clavo al rojo vivo se sumerge en el agua, el calor no fluida del agua caliente hacia aquel, sino del clavo caliente hacía el agua relativamente más fría. Enseguida se explicará detenidamente el fenómeno.
Transferencia de calor.
Siempre que existe una diferencia de temperatura entre dos cuerpos se dice que el calor fluye de una temperatura mayor a otra menor. Existen tres métodos fundamentales mediante los cuales ocurre el intercambio de calor.
· Conducción. Es la forma de propagación del calor a través de un cuerpo sólido, debido a la colisión entre las moléculas.
· Convección. Es la propagación del calor ocasionada por el movimiento de la sustancia caliente.
· Radiación. Es la propagación del calor por medio de ondas electromagnéticas esparcidas a una velocidad de 300000/, incluso en el vacío.
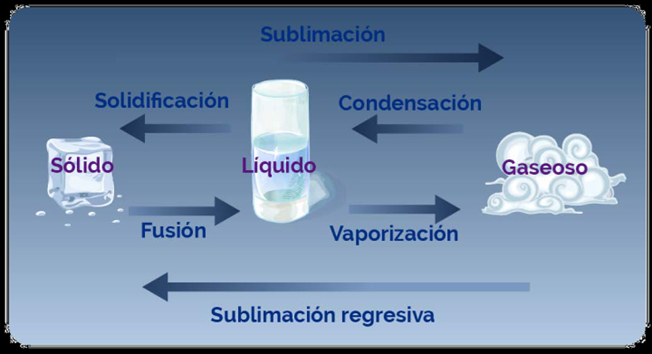
El calor influye de manera directa los cambios físicos del estado de la materia. La aplicación o extracción continua de calor a un sólido hubo un liquidada como resultado un cambio de estado, como en el siguiente proceso.
· Fusión es el cambio de estado sólido al líquido por un aumento de calor.
· Vaporización es el paso del estado líquido al estado gaseoso, un aumento de calor.
· Condensación que es el paso del estado gaseoso al líquido al sustraer calor.
· Solidificación es el paso del estado líquido al estado sólido al sustraer calor.
· Sublimación es el paso del estado sólido al gaseoso o viceversa, sin pasar por el estado líquido, por aumento o disminución de calor.









No hay comentarios.:
Publicar un comentario