En química es importante la cantidad de reactivos
empleados y productos generados. Así lo enuncia la Ley de la conservación de la
materia, al haber una transformación de materia, se espera que el número de
átomos que están del lado de los reactivos sea igual al del lado de los
productos.
Durante el estudio de la estequiometria se tiene la
oportunidad de aplicar lo aprendido, para entender, por ejemplo, la cantidad de
dióxido de carbono presente en la atmósfera, en función de la cantidad de
combustible que se quema para la generación de
energía.
A continuación, se presenta un ejemplo hipotético, con
el fin de mostrar de qué manera los cálculos estequiométricos son importantes en
las reacciones químicas.
Se tiene que para la generación de electricidad a
partir de gas natural se emplearon 50g de metano (CH4) y se quiere saber ¿Cuántos gramos de dióxido de
carbono se formarán?
1. Se escribe la
reacción, debe tomarse en cuenta que una reacción de combustión se realiza con
la presencia de oxígeno (O2), se
obtendrá agua (H2O) y dióxido de carbono (CO2).
2. Se
balance la ecuación para calcular el coeficiente estequiométrico. Se empleará el
método de tanteo.
|
Reactivos
|
Elementos
|
Productos
|
|
1
|
C
|
1
|
|
4
|
H
|
2
|
|
2
|
O
|
3
|
El balanceo de la reacción de combustión del metano
queda:
3. Después
se calculan los pesos moleculares. Para esto, se necesita la masa atómica,
aparece en la tabla periódica y se redondea.
|
Elementos
|
Peso atómico
o molecular
|
|
C
|
12 g/mol
|
|
H
|
2 g/mol
|
|
O
|
16 g/mol
|
|
PMt =
PMi x subíndice, donde PMt:
peso molecular de la sustancia = ΣPMi
PMi: peso
molecular del elemento i
PM
CH4
= PMC + PMH = (12g/mol) (1) + (1g/mol) (4) = 16
g/mol
PM O2 =
(16g/mol) (2) =
32g/mol
PM
CO2
= (12g/mol) (1) + (16 g/mol) (2) = 44
g/mol
PM H2O =
(1g) (2) + (16g) =
18g
|
4. Se
calcula la cantidad de CO2
producido por la quema de 50g de CH4
Los PM que sirven para este cálculo son los de
CH4
y CO2
y son:
Tenemos que a partir de 50g de CH4 se
generan 137.5g de CO2
· Se planteó la regla
de tres porque según la reacción (ya está balanceada), a partir de 16 g/mol de
metano (CH4)
se obtienen 44 g/mol de dióxido de carbono (CO2) pero lo que se quiere saber es cuánto
CO2
se genera a partir de 50g CH4.
Se ha hablado ampliamente de que las actividades
humanas han favorecido al aumento de los contaminantes que están modificando las
condiciones climáticas y la manera en la que se ha hecho frente a estos
cambios, mediante la mitigación y adaptación. ¿pero cómo la estequiometria
ayuda?
 Se
mencionó al principio que con la estequiometria es posible conocer la cantidad
de productos resultantes de una reacción. Pues un método de disminuir los GEI es
conociendo la cantidad de materia que tiene que reaccionar para la producción de
la energía que se consume durante un año en un país, además también se conocerá
la cantidad de contaminantes que se genere, permitiendo saber en qué sectores se
puedan disminuir la producción de gases contaminantes, inclusive optimiza los
procesos de producción y adoptando nuevas tecnologías generadoras de
energía.
Se
mencionó al principio que con la estequiometria es posible conocer la cantidad
de productos resultantes de una reacción. Pues un método de disminuir los GEI es
conociendo la cantidad de materia que tiene que reaccionar para la producción de
la energía que se consume durante un año en un país, además también se conocerá
la cantidad de contaminantes que se genere, permitiendo saber en qué sectores se
puedan disminuir la producción de gases contaminantes, inclusive optimiza los
procesos de producción y adoptando nuevas tecnologías generadoras de
energía.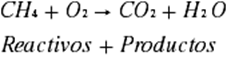




No hay comentarios.:
Publicar un comentario