Para los gases, la
presión y el volumen son inversamente proporcionales. si mantienes todo lo
demás constante y eleva la presión de un gas, su volumen disminuye. y mientras crece
el volumen que ocupa un gas, la presión se reduce.
Se aplica presión
sobre un gas, logrará que se comprima, haciendo que ocupe menos espacio.
Imagínate un contenedor rígido que mide cuántas veces las
partículas de un gas chocan contra los costados. Cuanto mayor sea el número de
partículas que chocan contra los costados mayor será la presión del gas en un
contenedor. Si achicas el contenedor, que harás es comprimir el gas con todas
las partículas de gas chocarán más veces contra los costados por cada segundo,
lo que significa que la presión es mayor. Si mantienes constante en la cantidad
de partículas de gas, pero agrandas el tamaño del contenedor, habrá menos
colisiones contra los costados por segundo. Esto implica que hay menor presión.
Robert Boyle descubrió la relación inversa entre la presión
y el volumen, determinando la como una Ley de los Gases. La ley de Boyle
sostiene que, para una cantidad de gas, a una temperatura constante, la presión
y el volumen son inversamente proporcionales:
Se puede elegir esto de una manera matemática escribiéndola
de la siguiente manera:
Donde P=presión, V=volumen y K=es la constante de
proporcionalidad.
Podemos reacomodar la ecuación para que se lea:
O, dicho de otro modo, el producto en la presión por el
volumen es una constante, k comentó de manera frecuente la ley de Boyle es
usada para comparar dos situaciones, una “antes” y una “después” en este caso
podrás decir que:
Con lo cual podrás escribir la ley de Boyle diciendo P1V1
=P2V2
Ejemplo 1
Un neumático con un volumen de 11.41 litros se lee en la
aguja medidora de presión como 44 psi (libras por pulgada cuadrada) ¿cuál sería
la nueva presión del neumático si lo comprimieras y dejaras su volumen en 10.6 litros?
Ley de Boyle: P1V1 =P2V2
Ejemplo 2
Una jeringa tiene un volumen de 10 cm³, la presión en 1.0
atm. si tapas el extremo para que no puede escapar ningún gas, y empujas el
vástago, ¿cuál debería ser el volumen final para cambiar la presión a 3.5 atm?
P1V1 =P2V2
La ley de Boyle vincula la presión con el volumen, pero
existen otras leyes de los gases que se relacionan con otras variables
esenciales vinculadas a ellos. la ley de charles rigen la relación entre la
temperatura y el volumen. la ley de Gay-Lussac rige en la relación entre la
presión y la temperatura. y la ley combinada de los gases pone a las tres
juntas: temperatura, presión y volumen. Ten en cuenta que para usar cualquiera
de estas leyes la cantidad de gas debe de ser constante. La ley de Avogadro
escribe la relación entre el volumen y la cantidad de gas (por lo general en
términos de N, la cantidad de moles). cuando combinamos las cuatro leyes
obtenemos la ley ideal de los gases:
(R= constante universal de los gases ideales)
Para
decidir cuál de las leyes de los gases utilizar al momento de resolver un
problema es conveniente hacer una lista para saber cuál es la información que
tienes que el cuál es la que necesitas. Si no cuentas con una variable y si se
mantiene constante en el problema, entonces no lo necesitarás en tu ecuación.




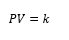







No hay comentarios.:
Publicar un comentario